Auf dieser Seite finden Sie Informationen zu unserer aktuellen Forschung.
Wir beschäftigen uns mit der synthetischen organischen Chemie in ihrer ganzen Breite. Dies beinhaltet die Entwicklung und Optimierung neuer synthetischer Prozesse, ihre detaillierte mechanistische Analyse sowie ihre Anwendung in der Totalsynthese komplexer Naturstoffe. Ein wichtiger Fokus liegt dabei auf der enantioselektiven Katalyse sowohl mit chiralen Organokatalysatoren als auch mit chiralen Übergangsmetall-Komplexen, die in der Lage sind, die absolute Konfiguration der Produkte zu kontrollieren. Das Anwendungspotential dieser Methoden demonstrieren wir im Kontext der Totalsynthese verschiedener Naturstoffe mit interessanten biologischen Eigenschaften.
Stereoselektive Reaktionen mit Silyldienolaten
Silyldienolate sind nucleophile C4-Bausteine, die unter Lewis- oder Brønsted-Säure-Aktivierung an Aldehyde, Imine und Michael-Akzeptoren addiert werden können und das Molekülgerüst um eben diese C4-Einheit erweitern. Die dabei gebildeten Reaktionsprodukte enthalten bis zu zwei neue stereogene Zentren, sind hochfunktionalisiert und für weitere Transformationen ideal geeignet.
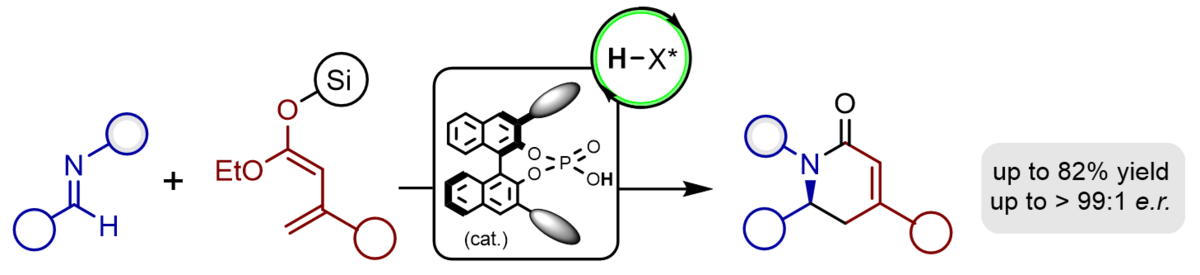
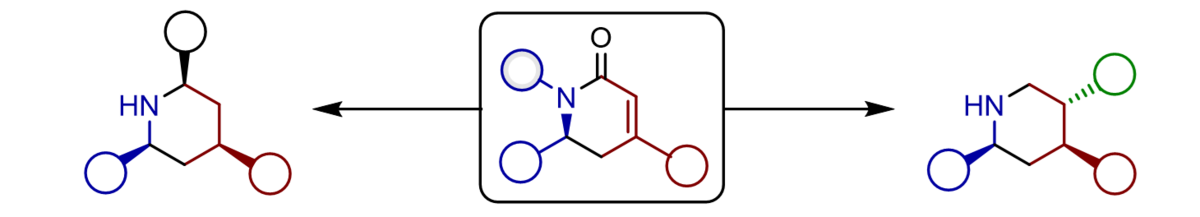
Wir haben die ersten katalytischen, enantioselektiven, vinylogen Mannich-Reaktionen der Silyldienolate ungesättigter Ester mit Iminen entwickelt, die wertvolle Aminosäureester mit exzellenten Ausbeuten, vollständiger Regioselektivität sowie exzellenten Enantio- und Diastereoselektivitäten zugänglich machen. Als chiralen Katalysator nutzen wir dafür lediglich 2-5 mol-% einer BINOL-basierten Phosphorsäure, die durch Protonierung des Imins chirale, hochreaktive Kontaktionenpaare erzeugt.
Die Verwendung von α-Silyloxy-substituierten Dienolaten liefert dagegen vinyloge Mannich-Produkte, die entweder an β-Position über das Silylenolatmotiv als Nucleophil mit weiteren Reaktionspartnern abreagieren oder nach Hydrolyse des labilen Silylenolatmotives über die elektrophile α-Position funktionalisiert werden. Je nach Reaktionsbedingungen und Reaktionspartnern konnten ausgehend von Lewis Säure-katalysierten vinylogen Mannich-Reaktionen diverse multicyclische Heterocyclen mit verschiedenen Substitutionsmustern in Eintopf-Sequenzen erhalten werden.
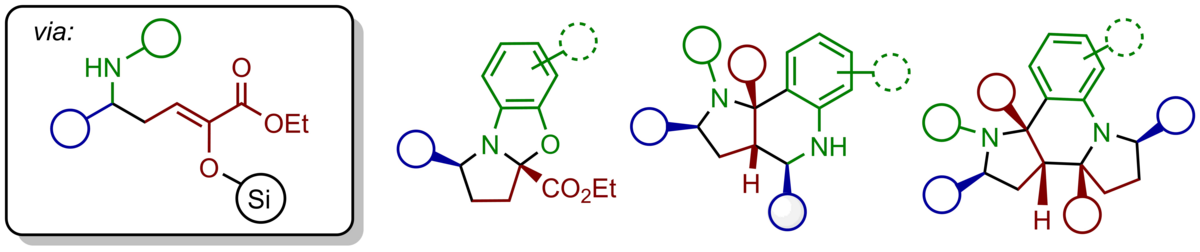
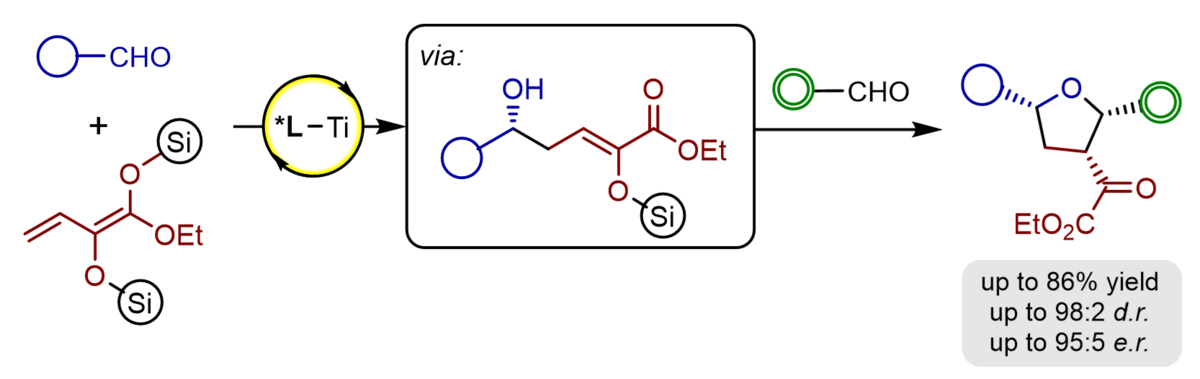
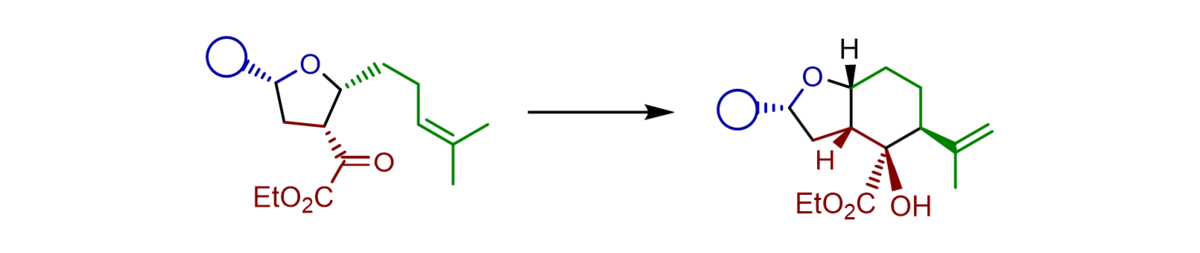
Hochsubstituierte, enantiomerangereicherte Tetrahydrofurane können durch eine Sequenz aus einer asymmetrischen Titan-(IV)-BINOLat-katalysierten Aldolreaktion von α-Silyloxy-substituierten Silyldienolaten gefolgt von einer Prins-Cyclisierung mit einem weiteren Aldehyd in einem Schritt aufgebaut werden- Die mit drei Stereozentren ausgestatteten und unsymmetrisch substituierten Produkte konnten typischerweise in guten Ausbeuten, hoher γ-Regioselectivität, sehr guter Diastereoselektivität sowie exzellenter Enantioselektivität von bis zu 95:5 e.r. erhalten werden. Mit ungesättigten Aldehyden kann die Sequenz um eine Carbonyl-En-Reaktion erweitert werden, die Octahydrobenzofurane mit zwei zusätzlichen stereogenen Zentren zugänglich macht.
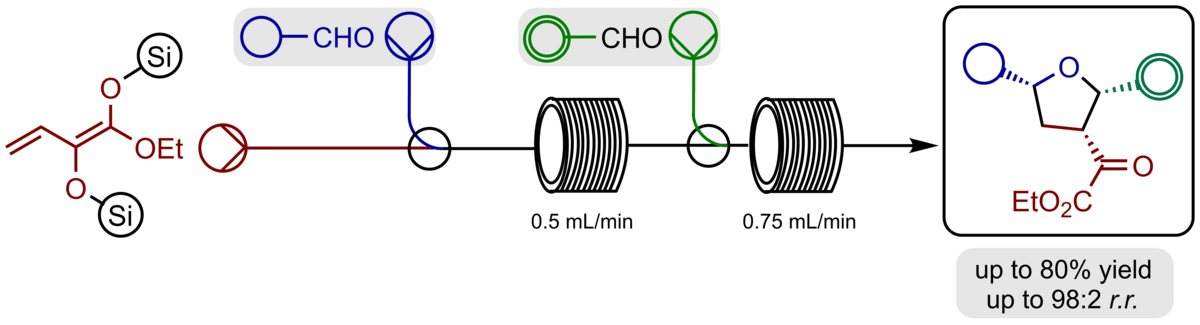
Für die Darstellung der hochfunktionalisierten unsymmetrisch-substituierten Tetrahydrofurane haben wir die gesamte Synthesesequenz in ein kontinuierliches Durchflussverfahren übersetzt, was die Selektivität und Ausbeute zugunsten der unsymmetrisch-substituierten Produkte verbessert und schnelle Synthesen im Multigramm-Maßstab erlaubt.
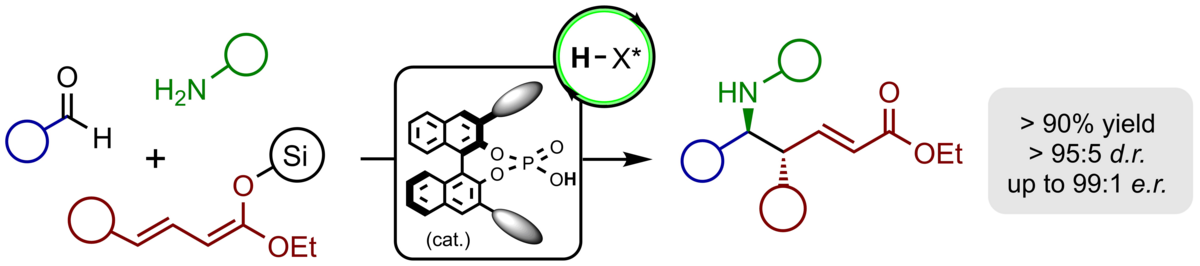
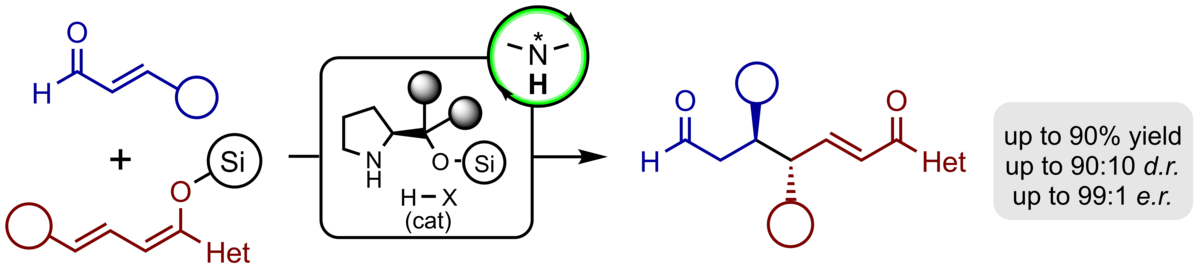
Wir haben die erste katalytische, enantioselektive vinyloge Michael-Reaktion von acyclischen Silyldienolethern entwickelt, die mit vollständiger Regio- und Enantioselektivität verläuft. In Gegenwart des Jørgensen-Hayashi-Katalysators werden die gewünschten Produkte in typischerweise guten Ausbeuten, vollständiger γ-Regioselektivität sowie exzellenter Enantioselektivität von >97% ee erhalten. Darüber hinaus wird bei Einsatz γ-substituierter Nucleophile ein zweites stereogenes Zentrum in den Produkten mit guter Diastereoselektivität von >10:1 generiert.
Bei der Verwendung von α-Silyloxy-substituierten Silyldienolaten in der katalytischen, enantioselektiven vinylogen Michael-Reaktion wurde eine anschließende Aldolkondensation der Aldehyd-Funktion mit dem intermediär gebildeten Silylenolat beobachtet. Die auf diesem Weg erhaltenen funktionalisierten chiralen Cyclopentene konnten mit hoher Regio- und Enantioselektivität und in guten Ausbeuten gebildet werden. Das in den Produkten enthaltene β,γ-konjugierte α-Ketoester-Motiv konnte mit diversen Reaktionspartnern weiter funktionalisiert werden und erlaubte den Zugang zu hochfunktionalisierten Cyclopentanen bis hin zu einer Reihe von multicyclischen Heterocyclen.
Ortho-Chinonmethide, Alkylidenindole und -pyrrole
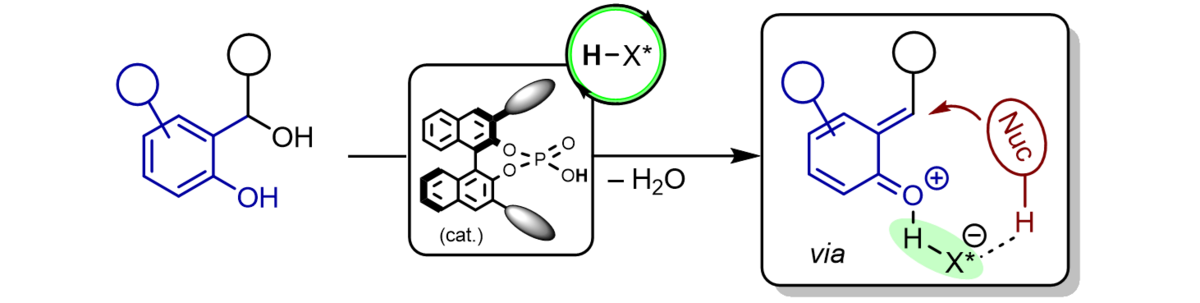
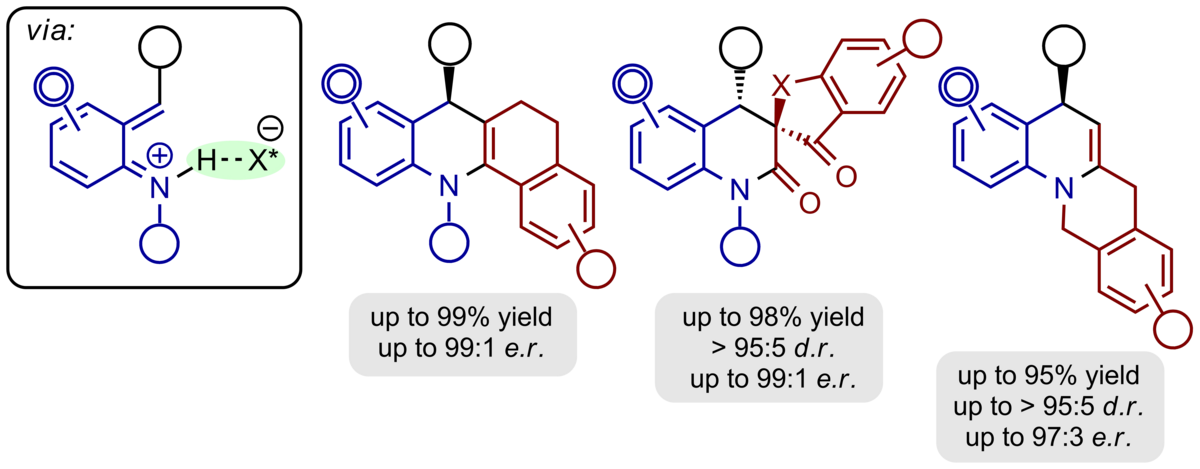
Ortho-Chinonmethide sind hochreaktive Syntheseintermediate, die erst vor kurzer Zeit in den Fokus des Forschungsinteresses gekommen sind. Wir erzeugen sie durch Brønsted-Säure-katalysierte Dehydratisierung von ortho-Hydroxybenzylalkoholen und lassen sie als polarisierte, elektronarme 1-Oxabutadiene mit elektronreichen π-Komponenten in Hetero-Diels-Alder-Reaktionen mit inversem Elektronenbedarf unter Rearomatisierung reagieren.
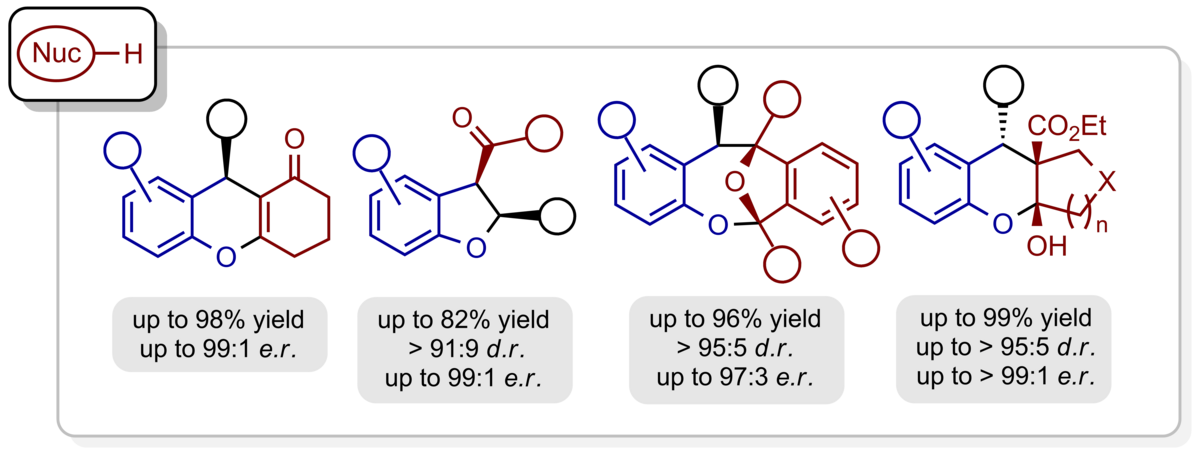
Mit Hilfe chiraler Phosphorsäuren als Organokatalysatoren konnten wir H-Brücken-gebundene ortho-Chinonmethide in-situ erzeugen und mit einer Fülle elektronreicher π-Nucleophile mit exzellenter Enantioselectivität umsetzen. β-Dicarbonylverbindungen, Enamide, enolreiche Aldehyde, Indole, Phenole sowie Diazoestes gehören dabei zu den am besten geeigneten Reaktionspartnern und lieferten benzanellierte 5-, 6- und 7-gliedrige Sauerstoff-Heterocyclen als hochenantiomerangereicherte Verbindungen.
Ortho-Chinonmethidimine weisen eine enge Verwandschaft zu den ortho-Chinonmethiden bezüglich Herstellung und Verwendung auf und können auf gleiche Weise durch chirale Brønsted-Säuren aktiviert, dirigiert und mit Reaktionspartnern umgesetzt werden. Auf diesem Weg konnten Hexahydroacridine, Dihydroquinoline und benzanellierte Chinolizidine mit hoher Enantioselektivität erhalten werden.
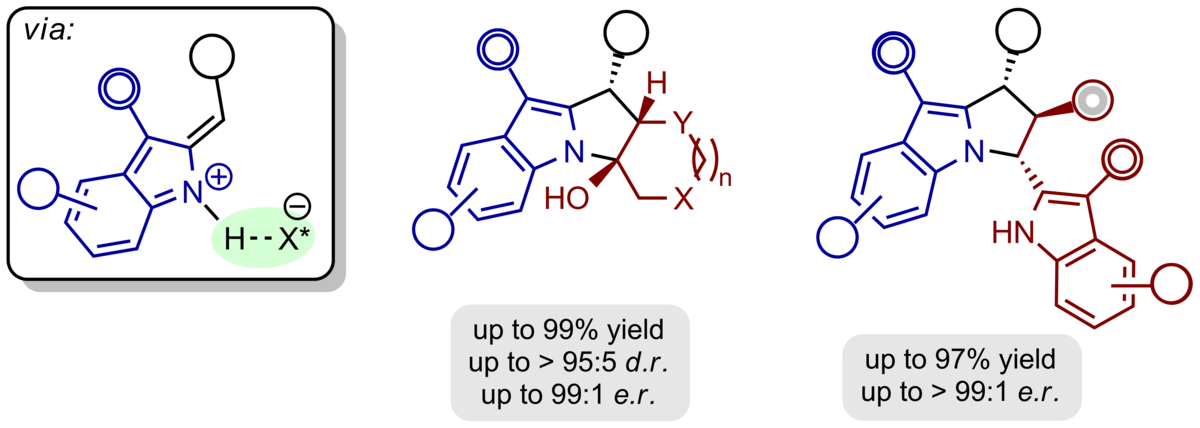
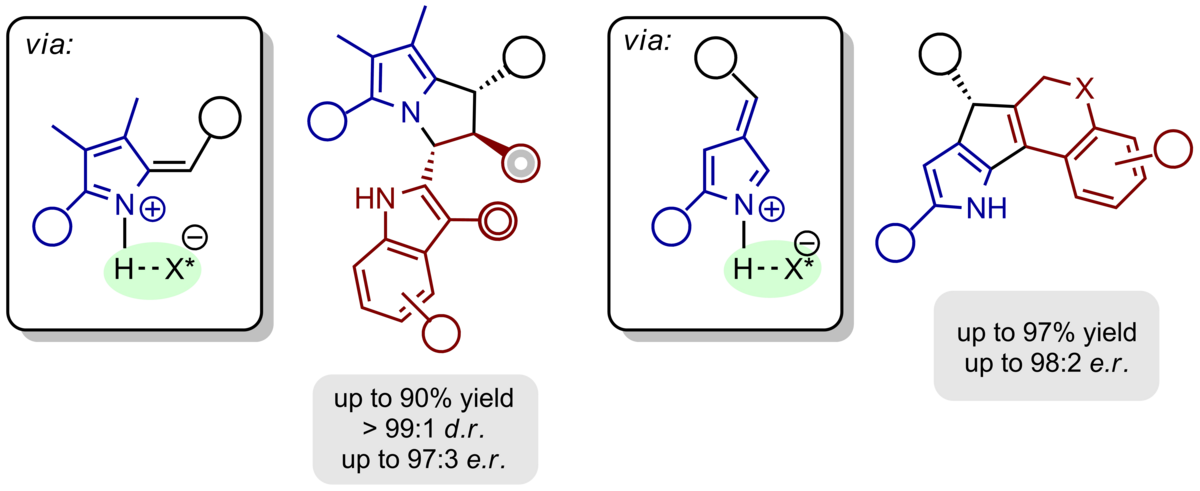
Das Konzept der ortho-Chinonmethide und -imine lässt sich direkt auf heterocyclische Motive übertragen. So können H-Brücken-gebundene, chirale Alkyliden-2H-indole und -2H-pyrrole durch säurekatalysierte Dehydratisierung aus den entsprechenden Alkoholen gewonnen und mit elektronreichen π-Nucleophilen in Pyrrolo[1,2-a]indole, 1H‑Pyrrolizine und Cyclopenta[b]pyrrole mit definierter absoluter und relativer Konfiguration umgesetzt werden.
Von der Synthesemethode zum fertigen Naturstoff
Unser langfristiges Ziel ist es, die neu entwickelten Synthesemethoden in größerem Kontext, vor allem in der Naturstoff-Synthese, einzusetzen, um ihr Potential zu evaluieren.
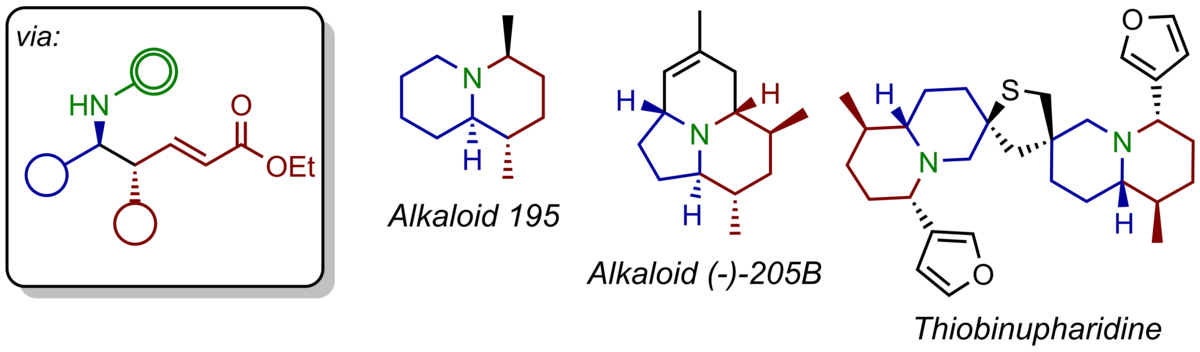
Die von uns etablierte enantioselektive, vinyloge Mannich-Reaktion ist ideal dazu geeignet, eine ganze Bandbreite von biologisch hochaktiven Alkaloiden in enantiomerangereicherter Form herzustellen. Im Besonderen können bicyclische Stickstoff-Heterocyclen wie Indolizidine und Chinolizidine, die als Pfeilgifte aus der Haut von Fröschen isoliert werden, als einheitliche Enantiomere durch unser modulares Konzept synthetisiert werden. Kürzlich konnten wir auf gleiche Weise die gegenwärtig kürzeste, enantioselektive Synthese des tricyclischen Alkaloids (-)-205B realisieren. Gegenwärtig ist eine Totalsynthese des dimeren Nupharalkaloids Thiobinupharidin in Bearbeitung.
Eine weitere Naturstoff-Klasse, die wir bearbeitet haben, sind die Polydeoxypropionate. Sie werden durch Bakterien, Pilze und Pflanzen produziert und weisen verschiedene sehr potente biologische Aktivitäten auf. Im Lichte ihrer signifikanten biologischen Aktivität sind weltweit große Syntheseanstrengungen unternommen worden, diese Naturstoffe stereoselektiv zu synthetisieren.
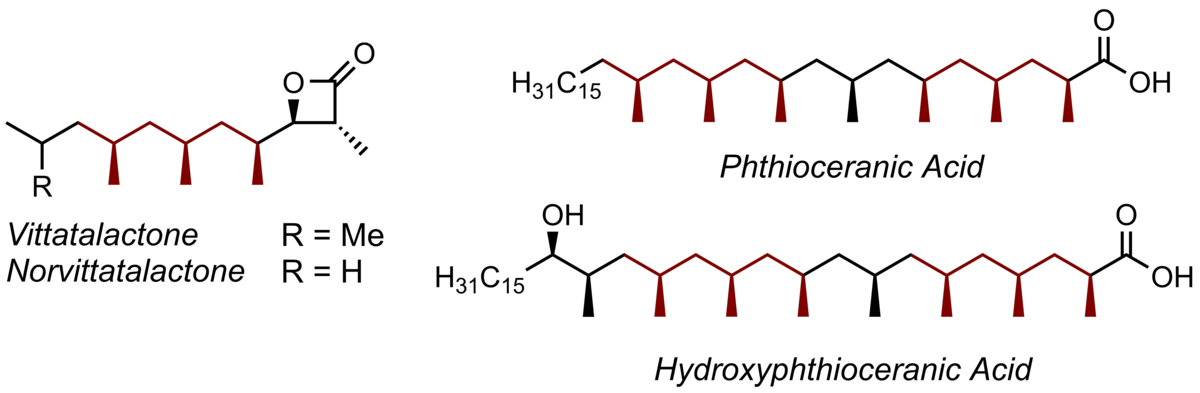
Wir haben dazu eine völlig neue und konzeptionell unterschiedliche Strategie entwickelt, die diese Naturstoff-Klasse erstmals nicht linear-iterativ, sondern hochkonvergent zugänglich macht. Die Insektenpheromone Vittatalacton und Norvittatalacton sowie die Lipidbestandteile Phthioceran- und Hydroxyphthioceransäure konnten mit Hilfe dieses Verfahrens als einheitliche Stereoisomere zugänglich gemacht werden.
![Synthese von funktionalisierten chiralen Cyclopentenen über eine Amin-katalysierte, vinyloge Michael-Reaktion als Bausteine für den Zugang zu diversen chiralen Kohlenstoff- und Heterocyclen, Abb. Marcel Sickert zur Vergrößerungsansicht des Bildes: Die Abbildung zeigt die asymmetrische Amin-katalysierte, vinyloge Michael-Reaktion von konjugierten Aldehyden mit dem Bis(silyl)diendiolat (links dargestellt) zur Synthese von funktionalisierten chiralen Cyclopentenen (mittig dargestellt), die weiter modifiziert werden können, wobei hier drei Möglichkeiten rechts abgebildet sind: chirale Cyclopentane, Tetrahydrocyclopenta[c]pyrazole und Sauerstoff-haltige Tricyclen.](/fileadmin/_processed_/7/a/csm_VMMichael-Reaktion_mit_Bis_silyl_diendiolat_01_d9d8acc81c.png)